[ad_1]
Desde los nemátodos hasta los humanos, la señalización a través de la familia de receptores Notch estimula el desarrollo embrionario, la diferenciación celular y la homeostasis de los tejidos. También es absolutamente esencial para convertir células inmunitarias humanas inmaduras en células T, que son células guerreras celulares que atacan virus y tumores.
Sin embargo, la activación de la señalización de Notch ha sido difícil de imitar in vitro, lo que hace que su explotación en la clínica sea casi imposible y obstaculiza los esfuerzos para producir terapias con células T. Pero esto podría cambiar.
En julio, los asistentes a una conferencia en Lewiston, Maine, dedicada a la señalización Notch, se quedaron sin dos nuevas herramientas para activar la vía. Sin conocerse, dos grupos de investigación trabajaban en paralelo para desarrollar lo que revelaron en la conferencia.
“Fue un punto de inflexión”, dice Juan Carlos Zúñiga Pfluker, inmunólogo del desarrollo de la Universidad de Toronto en Canadá, cuyo laboratorio fue pionero en varias técnicas de activación de Notch. Para él, los anuncios representaban “una especie de resurgimiento” de este negocio en Notch.
Problema con 2D
La mayoría de los receptores experimentan algún tipo de cambio conformacional después de unirse a sus ligandos, lo que desencadena una cascada de eventos que alteran el comportamiento de la célula. Pero la unión del ligando por sí sola no es suficiente para activar Notch.
Una vez que el receptor se une a su ligando (unido a otra célula), la célula que expresa el ligando se tambalea hacia el complejo ligando-receptor. Al igual que tirar de un hilo suelto en un suéter, la fuerza de tracción resultante expone parte del receptor Notch, exponiéndolo a enzimas que liberan el dominio intracelular del receptor y le permiten moverse hacia el núcleo para influir en la expresión genética.
Células madre para tratar enfermedades
“El verdadero desafío tecnológico es encontrar un fármaco que pueda imitar este efecto de arrastre”, dice Vincent Lucca, ingeniero de proteínas del Moffitt Cancer Center en Tampa, Florida.
Las estrategias actuales requieren el cocultivo de células que expresan receptores Notch con células que expresan el ligando, o la inmovilización del ligando en placas o perlas. Pero estos métodos “2D” no se pueden utilizar. vivodice Lucas.
También representan un cuello de botella para la producción generalizada de células T, dice George Daly, hematólogo y biólogo de células madre de la Facultad de Medicina de Harvard en Boston, Massachusetts, porque sólo las células en esa interfaz que presentan el ligando pueden activarse. Durante muchos años, el laboratorio de Daly luchó con las limitaciones de los métodos 2D mientras intentaba convertir células madre pluripotentes en células T.
En 2021, RuPaul Mott contactó a Daly, entonces investigador postdoctoral en la Universidad de Washington en Seattle en el laboratorio de David Becker, quien ganó una parte del Premio Nobel de Química de 2024 por su trabajo en el diseño de proteínas asistido por computadora. Maut quería aplicar estas técnicas de diseño a los sistemas basados en células madre de Dali.
Daly estaba “muy entusiasmado” con la idea, y antes de que Maut se uniera oficialmente a su laboratorio, hablaron sobre la ingeniería de agonistas de Notch solubles, que podrían entregar el ligando de Notch a las células en suspensión, en lugar de colocarlas sobre una superficie plana.
Las células CAR-T turboalimentadas disuelven tumores en ratones, utilizando un truco de las células cancerosas
Utilizando la herramienta de diseño de proteínas Rosetta desarrollada en el laboratorio de Baker, Daly, Mott y sus colegas diseñaron agonistas potenciales uniendo múltiples copias del ligando al andamio de la proteína. Experimentaron con diseños que contenían desde dos hasta 120 copias del ligando, así como diferentes geometrías.
Una disposición funcionó particularmente bien: tres copias del ligando irradian desde el andamio, como un radio. Cuando se añadió a células suspendidas que expresan Notch, este ligando multivalente unió las células microscópicamente. Paso de dosdonde cada célula T en desarrollo recluta (y activa) suavemente a la otra. En comparación con la activación 2D, la activación de Notch con un agonista soluble en un biorreactor dio como resultado una producción cinco veces mayor de células T por microgramo de agonista.1Lo que sugiere que este enfoque puede ser útil para fabricar células T a gran escala.
Refuerzo de incisión
Luca dice que su grupo, por el contrario, buscaba “una forma específica y enfocada de activar Notch”, con miras a la terapéutica. Por ejemplo, potenciar Notch puede reponer las células T agotadas que intentan destruir un tumor, pero debe hacerlo sin activar las células cancerosas, que también expresan Notch.
El laboratorio de Luca ha producido agonistas sintéticos de Notch (SNAG) (ver 'Imitadores de Notch'), fusionando un gen agonista de Notch con un gen que codifica parte de un anticuerpo que se dirige a las células cancerosas. El resultado codifica una proteína biespecífica que forma lo que Luca llama un “pequeño puente molecular” entre la célula que expresa Notch y la célula que expresa el antígeno canceroso. Este evento de unión activa mecánicamente el receptor de una manera similar a la señalización natural de Notch.2.
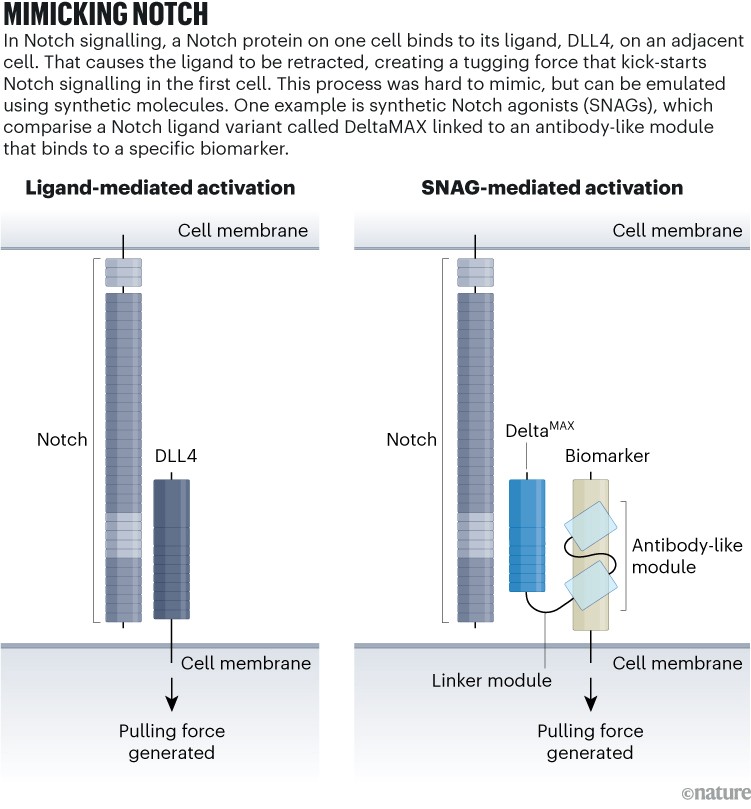
Fuente: Adaptado de referencia. 2
En enero se presentó un agonista soluble completamente diferente. El biofísico Björn Hojbjerg y su equipo del Instituto Karolinska de Estocolmo estudian pequeñas interacciones táctiles entre proteínas durante la señalización celular, que Hojbjerg compara con el “sistema Braille” que utilizan las células para comunicarse entre sí.
Trabajando con Luca, el equipo creó un agonista híbrido ADN-proteína uniendo múltiples copias del ligando Notch a lo largo de un trozo de ADN que se había doblado, al estilo origami, en una varilla. Para su sorpresa, el elevador activó a Notch sin generar ninguna fuerza de tracción mensurable.3.
Los investigadores sugieren que su agonista de origami puede desencadenar un mecanismo de activación alternativo, en el que la unión a largo plazo al ligando es suficiente para provocar que el receptor se disocia, aunque a un ritmo mucho más lento. Pero todavía están tratando de entender cómo podría funcionar esto.
Los cánceres altamente mutados responden mejor a la inmunoterapia
La reacción de la comunidad sobre la posibilidad de un mecanismo de activación de Notch independiente del arrastre fue mixta, dice Högberg: “Creo que algunos de ellos estaban realmente intrigados y realmente querían saber más, y otros decían: 'No', no lo sé”. No creo que eso sea nada.”
Por su parte, Zúñiga-Pfluker duda de que el vínculo del origami funcione sin ningún tipo de atracción gravitacional. Pero “el trabajo está realmente bien hecho”, afirma, y añade que “los tres artículos son muy interesantes en diferentes sentidos”.
Incluso hace sólo unos años, dice Mott, una vez más El diseño de proteínas no estaba lo suficientemente avanzado como para abordar una biología significativa. Pero el campo está evolucionando rápidamente, afirma, y se están resolviendo problemas reales. “Todo está encajando ahora”, dice.
[ad_2]
Source Article Link