[ad_1]
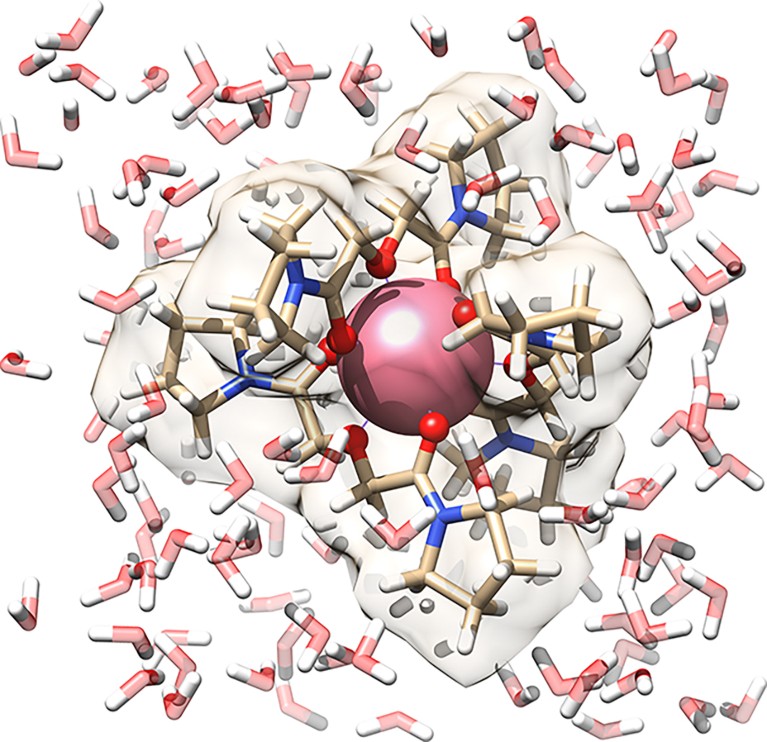
Los químicos han sintetizado un “complejo de coordinación” con el elemento prometio (rosa) en su centro. El oxígeno de las moléculas del complejo está en rojo y el nitrógeno en azul. En esta vista, las moléculas de agua en la solución que rodea el colector son rosadas y blancas.Crédito: DM Driscoll et al./naturaleza
Uno de los elementos más raros y misteriosos de Tabla periódica Finalmente reveló algunos secretos químicos importantes, ocho décadas después de su descubrimiento. Los investigadores del Laboratorio Nacional Oak Ridge en Tennessee se han convertido en los primeros en utilizar prometio radiactivo para fabricar un compuesto químico, en el que se une a una pequeña cantidad de moléculas circundantes. Esta hazaña de síntesis permitió al equipo estudiar cómo el elemento se une con otros átomos en una solución que contiene agua. Publicado hoy en naturaleza1Los hallazgos llenan un vacío de larga data en los libros de texto de química y eventualmente podrían conducir a mejores formas de separar el prometio de elementos similares en los desechos nucleares, por ejemplo.
“Es una experiencia asombrosa”, dice Polly Arnold, química del Laboratorio Nacional Lawrence Berkeley en Berkeley, California, que no participó en la investigación.
El prometio es el miembro más esquivo de la familia de los lantánidos, una fila de 15 metales varados en las regiones del sur de la tabla periódica. El elemento fue descubierto en 1945. su nombre era El nombre del gigante que robó el fuego a los dioses en la mitología griega. Los investigadores estiman que actualmente existe menos de un kilogramo de forma natural en la corteza terrestre, y su radiación se ha aprovechado anteriormente para alimentar marcapasos y naves espaciales.2.
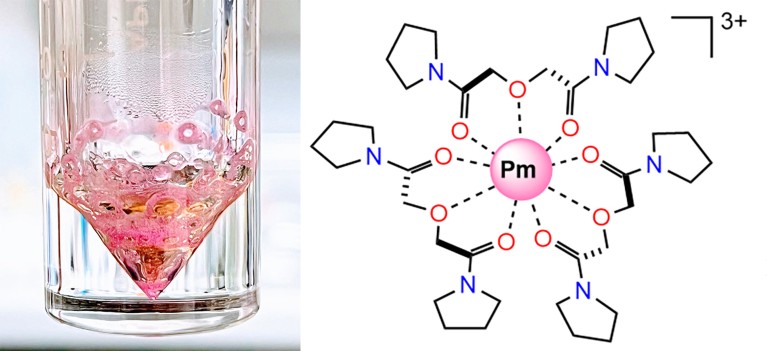
Para crear su complejo de coordinación con prometio (ver estructura 2D a la derecha), los investigadores primero recolectaron prometio-147 (que se muestra en el vial de la izquierda como una sal de nitrato) de desechos nucleares.Crédito: DM Driscoll et al./naturaleza
Los lantánidos, junto con otros dos metales, se conocen como elementos de tierras raras y muchos de ellos son apreciados por sus usos en tecnología, incluidos láseres e imanes potentes. Aunque muchos elementos de tierras raras abundan en la corteza terrestre, contrariamente a la intuición, están poco dispersos y pueden ser difíciles de aislar. Esto se debe en parte a que comparten una química notablemente similar, lo que dificulta extraer solo un componente de los lantánidos y aislarlo del resto.
Los métodos de separación actuales suelen utilizar moléculas conocidas como ligandos para unir iones de lantánidos cargados positivamente en solución, formando complejos de coordinación. Luego, los químicos pueden explotar las diferencias sutiles entre estos complejos para separarlos: por ejemplo, lavando selectivamente los complejos del agua usando solventes orgánicos. “Pero se necesitan muchísimas separaciones repetidas para llegar al material puro”, dice Ilya Popovs, químico de Oak Ridge que codirigió la investigación.
El prometio ha sido un libro cerrado para los investigadores que trabajan para mejorar los métodos de separación. Los químicos han logrado producir sólo unos pocos compuestos de prometio, todos los cuales son sólidos simples como el óxido.3 -pero nunca complejo muestra cómo el prometio puede unirse a los ligandos de separación en solución.
Prometio rodeado
Los investigadores de Oak Ridge llenaron este vacío utilizando prometio 147, un isótopo radiactivo con una vida media de aproximadamente 2,5 años, que recolectaron de los desechos generados durante la producción de plutonio radiactivo. Como todos los demás lantánidos, el prometio tiende a formar iones con una triple carga positiva.
El equipo combinó estos iones con un ligando llamado bispirolidina diglicolamida, que contiene tres átomos de oxígeno ricos en electrones. Tres de estos enlaces abrazaban cada ion prometio, generando complejos de nueve enlaces entre el prometio y el oxígeno.
Utilizando espectroscopia de absorción de rayos X y simulaciones teóricas, los investigadores midieron la longitud promedio de estos enlaces. También descubrieron que el oxígeno forma enlaces proporcionando pares de electrones que llenan claramente los niveles de energía vacíos, conocidos como orbitales, alrededor del prometio.
“Es un trabajo muy difícil, requiere habilidad y es realmente impresionante que hayan podido hacerlo”, dice Arnold, que estudia los lantánidos y sus primos más pesados, los elementos actínidos.
Completa el conjunto
Finalmente, para descubrir cómo se combinaba su compuesto de prometio con otros complejos de lantánidos, los investigadores de Oak Ridge combinaron el mismo compuesto con todos los demás lantánidos. Esto produjo el primer conjunto completo de complejos de lantánidos similares en solución y reveló cómo la longitud del enlace lantánido-oxígeno disminuye, de izquierda a derecha, a lo largo de la serie de lantánidos en la tabla periódica, como resultado de un efecto conocido llamado contracción de lantánidos.
El brometo (Pm) se encuentra en la serie de lantánidos de la tabla periódica.Crédito: Fuente científica/Biblioteca de imágenes científicas
Con cada paso a lo largo de la serie de los lantánidos, desde el lantano hasta el lutecio, cada elemento gana un protón y un electrón. Los protones se añaden al núcleo del átomo, mientras que los electrones se añaden a sus orbitales. Con los lantánidos, los electrones llenan gradualmente un conjunto particular de orbitales electrónicos conocidos como 4.F Son algo difusos y, por lo tanto, no “protegen” a los otros electrones cargados negativamente en el átomo de la creciente carga positiva en su núcleo. Esto permite que el núcleo ejerza una atracción más fuerte sobre algunos orbitales, encogiendo el átomo más de lo esperado.
Debido a que los enlaces en sus complejos de lantánidos donan electrones a los orbitales iónicos centrales, los investigadores de Oak Ridge pudieron ver la contracción de los lantánidos en las longitudes de los enlaces en todo su grupo recién sintetizado. También observaron que la disminución en la longitud del enlace en la primera parte de la cadena, del lantano al prometio, era más pronunciada que en la última parte de la cadena. Aunque estos resultados no son particularmente sorprendentes, dice Alexander Ivanov, químico de Oak Ridge que codirigió el trabajo, “fue emocionante confirmar que esta contracción de lantánidos también estaba presente en la solución”.
[ad_2]
Source Article Link

