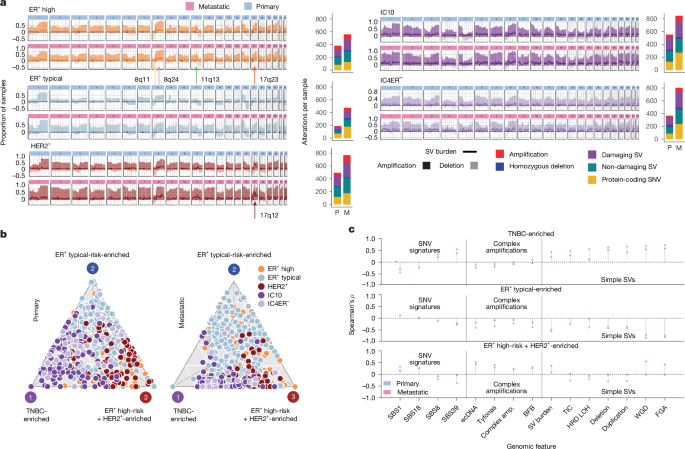
Los subtipos de IC tienen distintos paisajes CNA (Datos ampliados, figura 1). 1j), pero no se ha investigado el panorama de SV y su evolución. Aprovechando ENiClust, descubrimos que el panorama genómico del subgrupo IC de cáncer de mama es estable durante la progresión de la enfermedad a pesar de una mayor carga de alteraciones.10,13,16,17 (higo. 2a Formato de datos extendido. 2a,b). Ambos HER2+ y ER+ Los tumores primarios y metastásicos de alto riesgo muestran distintos aumentos agudos en la carga de VS en sus sitios frecuentemente amplificados (IC5: 17q12; IC6: 8p11; IC2: 11q13; IC1: 17q23). La carga máxima de SV es en 17q12 (ERBB2) sugiere que ERBB2 La amplificación se ve reforzada por modificaciones complejas, como el ecDNA.18. Carga mutacional en sala de emergencias primaria+ Los tumores de riesgo típicos fueron mínimos (Figura complementaria S1). 1 tonelada) pero aumentó en la enfermedad metastásica (Figura 1). 2a), en parte debido al tratamiento (Datos ampliados, figura 1). 2c). IC10 y IC4ER– Los tumores muestran una inestabilidad difusa en todo el genoma con una mayor carga de SV, aunque estos últimos muestran un patrón atenuado y contienen menos SV patógenos y alteraciones en las vías de reparación del ADN, lo que confirma informes anteriores.19 (Datos ampliados fig. 2d, mi). En todos los sitios metastásicos, la carga acumulada de alteraciones fue mayor en las metástasis pulmonares y subcutáneas y menor en los tejidos blandos y la recurrencia en la mama (Datos ampliados, figura 1). 2f). Estas alteraciones específicas de subgrupos se observan en CDIS (Datos ampliados, figura 1). 2a), con especial atención a los oncogenes de adicción temprana y los mecanismos de transformación maligna.
A continuación, caracterizamos las firmas de CNA y SV en 702 tumores de mama primarios, lo que produjo 24 replicaciones de CNA.20 Y 6 reordenamientos8,21 Firmas (RS) informadas anteriormente (Figura complementaria S1). 2a-c). RS3, RS5 (asociado con deficiencia de reparación homóloga (HRD); Figura complementaria 1). 2d) y CN17 se enriquecieron en tumores IC10, mientras que RS4, RS6 (asociados con amplificaciones complejas) y CN7 se enriquecieron en el ER.+ Alto riesgo y HER2+ Tumores (Datos ampliados, Figura 1). 2 gramos,h Y la cifra suplementaria. 2e-g). Él es+ Los tumores con riesgos típicos se enriquecieron con CN1 (asociado con genomas diploides; Figura complementaria S1). 2d, mi).
Proyectado en un plano 2D (Figura complementaria 1). 3a,b), las características arquitectónicas siguen un continuo y forman un poliedro que recuerda al óptimo de Pareto, lo que explica las compensaciones entre tareas biológicas22. Los cánceres de mama primarios se asignan a tres modelos genéticos dominantes (Figura 1 complementaria). 3c-f): TNBC enriquecido, ER+ Típico rico en riesgos y ER+ HER2+ de alto riesgo+– Enriquecido. Los tumores dominados por un solo proceso mutacional están cerca del ápice, mientras que los tumores caracterizados por múltiples procesos se agrupan en el centro (Figura 1a). 2b Formato de datos extendido. 2i). El arquetipo enriquecido en TNBC se asoció positivamente con la inestabilidad genómica y los SNV de desregulación de HRD y APOBEC (Figura 1a). 2c Y la cifra suplementaria. 3 gramos). En comparación con la sala de emergencias+ Tumores de alto riesgo, HER2+ Los tumores se enriquecieron con Typhionas (Datos ampliados, figura 1). 2j). sala de emergencia+HER2+ de alto riesgo+ El arquetipo enriquecido se asoció positivamente con amplificaciones complejas, especies reactivas de oxígeno y SNV asociados a APOBEC que albergan coamplificación de múltiples dominios celulares (Datos ampliados, figura 1). 3a). En cambio, E.R.+ El arquetipo enriquecido se asocia negativamente con la mayoría de los rasgos genómicos.
Se predice que los tumores serán similares a BRCA en función de las características genómicas somáticas o de la línea germinal23 Mapa del arquetipo enriquecido con TNBC (Datos ampliados, figura 1). 3b). De hecho, ambos ER se parecen a BRCA1 y BRCA2.+ y ER– Los tumores mostraron puntuaciones de arquetipo TNBC significativamente más altas que los tumores no HRD, y ER similar a HRD.+Los tumores de alto riesgo estaban más cerca del arquetipo enriquecido con TNBC que sus homólogos sin HRD (OR = 5,09; pag= 6,5 x 10-4 ). Además, los patrones mutacionales similares a BRCA1 y BRCA2 ER– y ER+ Los tumores eran altamente compatibles (Figura complementaria S1). 3h, edición). En particular, el 43,6% de los tumores TNBC se parecían a los HRD y el 13,2% de los tumores ER.+ También se espera que los tumores de alto riesgo sean similares a los HRD, la mayoría de los cuales son ER+IC1 o IC9 de alto riesgo (OR = 4,43; pag= 0,03; Formato de datos extendido 3c Y la cifra suplementaria. 3j). De hecho, aunque las inversiones de plegamiento y las inversiones de pirgosa se enriquecieron en TNBC (inversión de plegamiento: 17,3%, pag= 2,00 x 10-3; Pirgos: 18,8%, pag= 9,33 x 10-4 ), y estos eventos mutacionales también se han observado en la sala de emergencias.+ tumores (5,1% y 4,1%, respectivamente; Datos ampliados, Figura 1). 3D). Estos datos refuerzan múltiples mecanismos de inestabilidad genómica en TNBC24 Lo que también afecta a un subconjunto del ER+ Tumores.
Los tres modelos genómicos se replicaron en una cohorte independiente de 2229 tumores primarios de Genomics England.21 (Datos ampliados fig. 3AH). En general, el panorama genómico de los tumores de mama primarios se encuentra a lo largo de un continuo de patrones mutacionales capturados por tres modelos genómicos principales, los genomas diploides estables (ER).+ Enriquecido en riesgos típicos), inestabilidad de todo el genoma (enriquecido en TNBC) y amplificaciones focales complejas (ER+HER2+ de alto riesgo+ – enriquecido).
Las lesiones metastásicas muestran mayores cargas de SNV y SV en comparación con los tumores primarios no asociados, posiblemente debido al tratamiento, como hemos demostrado nosotros y otros.13,17. Utilizando el enfoque anterior, identificamos seis firmas SV de novo en metástasis que se correlacionan con las de tumores primarios (Figura complementaria S1). 4a, b) y mostraron patrones de enriquecimiento específicos de subgrupos similares (Figura 1 de datos ampliados). 3f). La proyección 2D reveló nuevamente tres arquetipos dominantes (Figura complementaria S1). 4 tazas) que se superponen con los encontrados en tumores primarios (Figura 1). 2b,c,Formato de datos extendido. 3 gramos Y la cifra suplementaria. 4 días). Nuestros resultados fueron sólidos ante la elección del algoritmo de reducción de dimensionalidad (Figura complementaria S1). 4e-g). Por tanto, los tres modelos genómicos de cáncer de mama se conservan en la enfermedad metastásica.
Las firmas SV generalmente se mantuvieron, aunque aumentaron, en los tumores metastásicos con la excepción de RS4 y RS6 en la sala de emergencias.+ Alto riesgo y HER2+ tumores, respectivamente, que se mantuvieron estables (Datos ampliados, Figura 1). 3 horas). Estos datos respaldan la aparición temprana de reordenamientos complejos y su persistencia durante la metástasis. Aunque la distribución de las huellas dactilares del CNA refleja tumores primarios, el frente de Pareto reveló una mayor carga de alteración y perfiles más mixtos en la metástasis, lo que es consistente con una mayor duplicación del genoma completo e inestabilidad genómica.17 (Datos ampliados Fig. 3 toneladas Y la cifra suplementaria. 4 horas, yo). Por tanto, los tumores metastásicos conservan las cicatrices de procesos mutacionales específicos de un subconjunto que operan en la fase temprana de la enfermedad.
a pesar de+ Los tumores de riesgo típicos tienen un pronóstico favorable, y el 29% de los pacientes experimentan una recaída a distancia4. Investigamos si los modelos genómicos mejoran la estratificación del riesgo. Establezca METABRIC en el frente de Pareto (Golpear,Formato de datos extendido. 3j Y la cifra suplementaria. 4 días-l), posición de urgencias+ Los tumores de gravedad típica predecían la recaída, y los tumores recurrentes se encontraban más cerca de la sala de emergencias.+ HER2+ de alto riesgo+ Modelo original (datos ampliados fig. 3k,l) se acompaña de un mayor grado de pérdida de heterocigosidad en la histología de HRD y de carcinoma lobulillar invasivo (CLI) y de una mayor proliferación.
En METABRIC, las ILC se enriquecieron en la ER+Tumores con riesgo típico (OR = 2,20, pag= 2,27 x 10-3 prueba exacta de Fisher; Figura complementaria. 4 metros). Dentro de urgencias+ Los tumores de alto riesgo, los SC, mostraron un mayor riesgo de recurrencia a 5 años (39 % frente a 30 %) y riesgo de recurrencia acumulada (62 % frente a 54 % a 20 años; Datos ampliados, Figura 1). 3m). Esta diferencia fue más pronunciada entre ER+ Tumores con riesgo típico (55% vs. 37% a los 20 años). Las ILC estaban más cerca de la sala de emergencias+El modelo de riesgo original para sus homólogos del carcinoma ductal invasivo (IDC) (pag= 2,10 x 10-5; Formato de datos extendido 3 norte, s) debido a sus bajos niveles de duplicación del genoma completo, ploidía y diploidía parcial del genoma. Por tanto, dadas estructuras genómicas similares, la histología lobulillar sigue siendo un rasgo de alto riesgo.