[ad_1]

La observación de un enlace de un solo electrón en el carbono, un componente básico de la vida en la Tierra, ha entusiasmado a los científicos.Fotografía: Dominique Reuter/AFP vía Getty
Desde hace poco más de un siglo, Farmacia Se cree que los enlaces atómicos fuertes llamados enlaces covalentes se forman cuando los átomos comparten uno o más pares de electrones. Ahora, los investigadores han realizado las primeras observaciones de enlaces covalentes de un solo electrón entre dos átomos de carbono.
Este comportamiento de enlace inusual se ha observado en algunos otros átomos, pero los científicos están particularmente entusiasmados de verlo en el carbono, el elemento básico de la vida en la Tierra y el componente principal de los productos químicos industriales, incluidos medicamentos, plásticos, azúcares y proteínas. El descubrimiento fue publicado.1 en naturaleza El 25 de septiembre.
“El enlace covalente es uno de los conceptos más importantes de la química, y el descubrimiento de nuevos tipos de enlaces químicos es muy prometedor para ampliar vastas áreas del espacio químico”, dice el químico Takuya Shimagiri de la Universidad de Tokio, que formó parte del grupo de carbono. investigación de vinculación. un equipo.
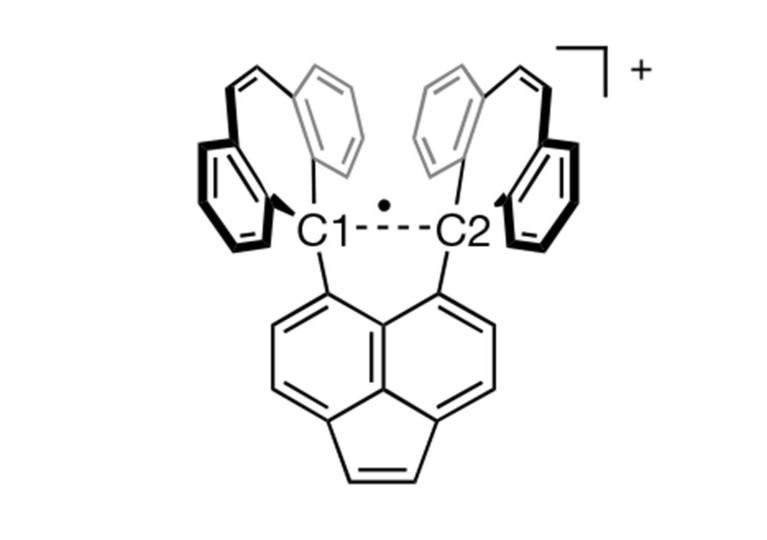
Se produce un enlace de un solo electrón debido a que el enlace carbono-carbono central se estira, lo que lo hace vulnerable a perder un electrón.Crédito: Takuya Shimagiri et al./naturaleza
La mayoría de los enlaces químicos en las moléculas constan de un solo par de electrones, compartido entre átomos. Estos se llaman enlaces covalentes simples. En enlaces particularmente fuertes, los átomos pueden compartir dos pares de electrones en un doble enlace, o tres pares en un triple enlace. Pero los químicos saben que los átomos interactúan de muchas otras maneras y, al estudiar tipos de enlaces inusuales en los límites de lo posible, esperan comprender mejor qué es un enlace químico.
La sugerencia de Pauling.
El concepto de enlaces covalentes de un solo electrón se remonta a 1931, cuando fue propuesto por el químico Linus Pauling. Pero en aquella época los químicos no tenían las herramientas para observar esos enlaces, afirma Marc-Étienne Moret, químico de la Universidad de Utrecht, en los Países Bajos. Incluso con técnicas analíticas modernas, estos vínculos son difíciles de observar. “Una situación en la que sólo un electrón forma un enlace es muy inestable”, afirma Moret. “Esto significa que el enlace se romperá fácilmente y tiene una fuerte tendencia a liberar o capturar un electrón para recuperar un número par de electrones”.
En 1998, los científicos notaron2 Un enlace de un electrón entre dos átomos de fósforo; Moret formó parte del grupo que lo creó3 Uno entre cobre y boro en 2013. Los químicos han planteado la hipótesis de que estos enlaces inusuales pueden ocurrir entre átomos de carbono en estructuras intermedias de vida corta que aparecen durante reacciones químicas. Pero para observar estos enlaces volátiles, los químicos deben estabilizar el compuesto que los contiene. Un compuesto estable que contiene un enlace C-C de un electrón ha eludido a los químicos.
La clave para observar un enlace de carbono de un electrón, dice Shimagiri, es diseñar cuidadosamente una molécula que lo estabilice. El equipo de investigación, que incluía al químico Yusuke Ishigaki de la Universidad de Hokkaido, creó una molécula que proporciona una “capa” estable de anillos de carbono fundido que ayuda a unir un enlace carbono a carbono en su centro. Este enlace central se extiende a una longitud relativamente larga en relación con el enlace C-C, lo que lo hace vulnerable a perder un electrón en la reacción redox, creando un enlace esquivo de un electrón.
Finalmente se ha descubierto un isótopo de oxígeno poco común que desafía las expectativas
Enlace estable
Para que este compuesto adquiriera una forma estable y observable, lo cristalizaron. Cuando la oxidación se lleva a cabo en presencia de yodo, la reacción produce una sal de color púrpura, con la capa estable de la molécula sosteniendo un enlace C-C de un electrón en su interior. Luego utilizaron diferentes técnicas analíticas para caracterizar la molécula y el enlace. Shimagiri dice que el compuesto es muy estable en condiciones ambientales.
“En muchas reacciones químicas se han propuesto enlaces de un solo electrón, pero hasta ahora han sido hipotéticos”, afirma Shimagiri. La creación de compuestos estables que contengan estos enlaces puede ayudar a los investigadores a comprender mejor lo que sucede durante estas reacciones.
Guy Bertrand, químico de la Universidad de California en Santa Bárbara, formó parte del equipo que creó el enlace de fósforo de un electrón. Dice que es importante verlo en carbono. “Cada vez que se hace algo con el carbono, el impacto es mayor que con cualquier otro elemento”, afirma. El carbono es una sustancia de la química orgánica.. Pero dice que no es fácil decir si este trabajo tendrá alguna aplicación. “Eso es curioso”, dice. “Pero estará en los libros de texto”.
Shimagiri espera que describir el enlace de carbono de un electrón ayude a los químicos a comprender mejor la naturaleza fundamental de los enlaces químicos. “Nuestro objetivo es aclarar qué es un enlace covalente; específicamente, ¿en qué punto el enlace es covalente y en qué punto no lo es?”
[ad_2]
Source Article Link


