[ad_1]
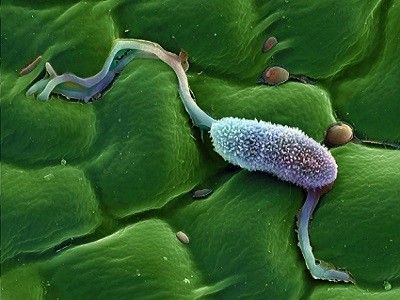
Una célula vegetal que contiene cloroplastos (verde oscuro), orgánulos especializados que los científicos creen que evolucionaron a partir de endosimbiontes.Crédito: Dr. David Furness, Universidad de Keele/Biblioteca de imágenes científicas
Los científicos que utilizaron una pequeña aguja hueca (y una bomba de bicicleta) pudieron trasplantar bacterias a una célula más grande, creando una relación similar a la que provocó la evolución de la vida compleja.
Hazaña – descrita1 en naturaleza 2 – Podría ayudar a los investigadores a comprender los orígenes del apareamiento que dio origen a orgánulos especializados llamados mitocondrias y cloroplastos hace más de mil millones de años.
Los hongos han tomado prestado el gen bacteriano una y otra vez
Las relaciones endosimbióticas (en las que un microbiano vive armoniosamente dentro de las células de otro organismo) se encuentran en muchas formas de vida, incluidos insectos y hongos. Los científicos creen que las mitocondrias, los orgánulos responsables de producir energía en las células, evolucionaron cuando las bacterias se asentaron dentro del ancestro de las células eucariotas. Los cloroplastos aparecieron cuando un ancestro de las plantas ingirió un microorganismo fotosintético.
Es difícil determinar qué factores dieron forma y persistieron a estos emparejamientos, porque ocurrieron hace mucho tiempo. Para superar este problema, un equipo dirigido por la microbióloga Julia Voorholt, del Instituto Federal Suizo de Tecnología en Zurich (ETH Zurich), ha pasado los últimos años diseñando el endosimbionte en el laboratorio. Su método utiliza una aguja de 500-1000 nanómetros de ancho para perforar las células huésped y luego conectar las células bacterianas una por una.
Emocionante convivencia
Incluso con esta magia técnica, los emparejamientos iniciales tienden a fallar; Por ejemplo, porque el posible simbionte se dividió muy rápidamente y mató a su anfitrión.2. La suerte del equipo cambió cuando recrearon la simbiosis natural que se produce entre algunas cepas de hongos patógenos de plantas. Rhizobus microsporay bacterias Mycetohabitans rhizoxinicaLo cual produce una sustancia tóxica que protege al hongo de la depredación.
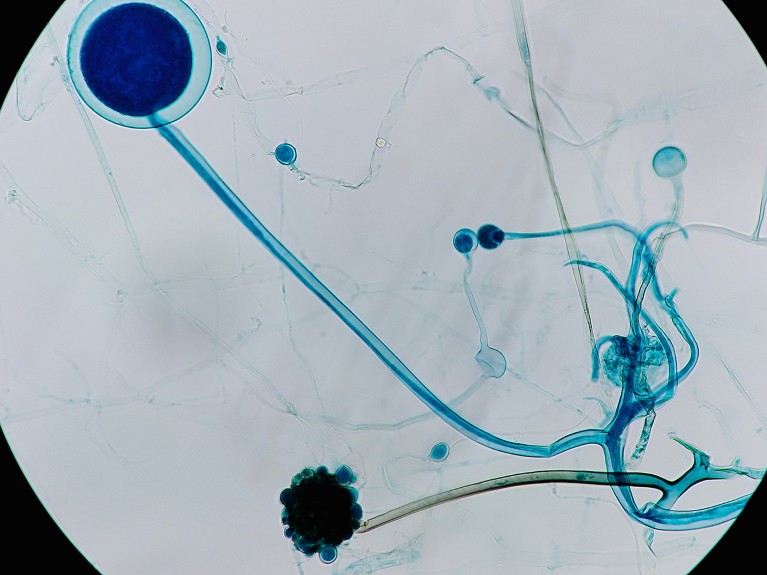
Los investigadores cultivaron la bacteria en… Rizopus Hongos: vistos aquí bajo un microscopio.Crédito: SRMY/Shutterstock
Sin embargo, ha sido un desafío entregar células bacterianas a los hongos, que tienen paredes celulares gruesas que mantienen una alta presión interna. Después de perforar la pared con la aguja, los investigadores utilizaron una bomba de bicicleta (y más tarde un compresor de aire) para mantener suficiente presión para liberar las bacterias.
Tras superar el shock inicial de la cirugía, los hongos continuaron su ciclo de vida y produjeron esporas, algunas de las cuales contenían bacterias. Cuando estas esporas germinaron, las bacterias también estaban presentes en las células de la siguiente generación de hongos. Esto demostró que el nuevo endosimbionte podría transmitirse a la descendencia, un descubrimiento clave.
La desaparición de las bacterias.
Pero el éxito de la germinación de las esporas que contienen bacterias fue bajo. En una población mixta de gérmenes (algunos que contenían bacterias y otros no), aquellos que sí contenían bacterias desaparecieron después de dos generaciones. Para ver si las relaciones podían mejorarse, los investigadores utilizaron un clasificador de células fluorescentes para seleccionar las esporas que contenían las bacterias (que fueron marcadas con una proteína brillante) y propagaron sólo estas esporas en futuras rondas de reproducción. Después de diez generaciones, las esporas que contenían bacterias germinaban con la misma eficacia que las que no tenían bacterias.
La base de esta adaptación no está clara. La secuenciación del genoma identificó una pequeña cantidad de mutaciones asociadas con un mayor éxito de germinación en el hongo, que era una cepa de r. microsporo No se sabe que porten endosimbiontes de forma natural y no se han encontrado cambios en las bacterias.
La línea que germinó de manera más eficiente tendió a limitar la cantidad de bacterias por espora, dice el coautor del estudio Gabriel Geiger, microbiólogo de ETH Zurich. “Hay maneras para que estos dos socios tengan una vida mejor y más fácil el uno con el otro. Esto es algo que es muy importante que comprendamos”.
El sistema inmune innato
Los investigadores no saben mucho sobre genética. r. microsporo. Pero Thomas Richards, biólogo evolutivo de la Universidad de Oxford en el Reino Unido, se pregunta si el sistema inmunológico innato impide la convivencia y si las mutaciones en este sistema podrían facilitar las relaciones. “Soy un gran admirador de este trabajo”, añade.
Eva Nowak, microbióloga de la Universidad Heinrich-Heine de Düsseldorf en Alemania, quedó sorprendida por la rapidez con la que evolucionó la adaptación a la vida simbiótica. En el futuro, le gustaría ver qué sucede después de períodos de tiempo más largos; Por ejemplo, más de 1000 generaciones.
Diseñar tal simbiosis podría conducir al desarrollo de nuevos organismos con características útiles, como la capacidad de consumir dióxido de carbono o nitrógeno atmosférico, dice Vorholt. “Ésa es la idea: incorporar nuevas características que el organismo no tiene y que de otro modo serían difíciles de implementar”.
[ad_2]
Source Article Link